Lichtgevende garnaal zorgt voor sneller opsporen infectieziekten
Hoogleraar Maarten Merkx over een breder inzetbaar alternatief voor PCR-testen
Lees meer- Onderzoek
- 14/02/2024
Lichtgevende garnaal zorgt voor sneller opsporen infectieziekten
De PCR-test was de gouden standaard tijdens de coronapandemie. De coronagolven zijn geluwd, maar mocht er weer een pandemie uitbreken, dan wordt er in de onderzoeksgroep van TU/e-hoogleraar Maarten Merkx hard gewerkt aan een sneller en goedkoper alternatief. De sterspeler in deze methode: een lichtgevende garnaal.
Menig persoon zal het gevoel van een wattenstaafje in de neus maar moeilijk kunnen vergeten. “Liever in uw linker- of uw rechterneusgat?” klonk het regelmatig in de vele coronatestlocaties. Maar wat doet een PCR-test precies?
Vermenigvuldigen van genetisch materiaal
“PCR (polymerase chain reaction, red.) is een methode waarmee van één DNA-molecuul, vele kopietjes gemaakt kunnen worden,” vertelt Maarten Merkx, hoogleraar Protein Engineering bij de faculteit Biomedical Engineering. Indien je besmet bent bevat jouw neusvocht op het wattenstaafje namelijk genetisch materiaal van het virus, in de vorm van DNA of RNA.
De hoeveelheid genetisch materiaal is vaak minimaal op zo’n wattenstaafje. Zo weinig dat er niet betrouwbaar getest kan worden of je besmet bent of niet. PCR is een methode om uit kleine hoeveelheden genetisch materiaal (zoals op het wattenstaafje) een specifiek gedeelte heel vaak te vermenigvuldigen. Net zo lang tot dat er voldoende aanwezig is om het te kunnen detecteren. Dit kopieerproces gebeurt aan de hand van een drietal stappen die heel vaak herhaald worden. Hierbij worden de twee DNA-strengen eerst bij hoge temperaturen uit elkaar ‘gesmolten’, waarna bij lagere temperaturen de specifieke DNA-sequentie wordt afgebakend en gekopieerd.
Een PCR-test voor corona (COVID-19) vermenigvuldigt een specifieke sequentie van het coronavirus-RNA, zodat je aan de hand van de test kunt zien of dit wel of niet aanwezig is en dus of de persoon wel of niet besmet is.
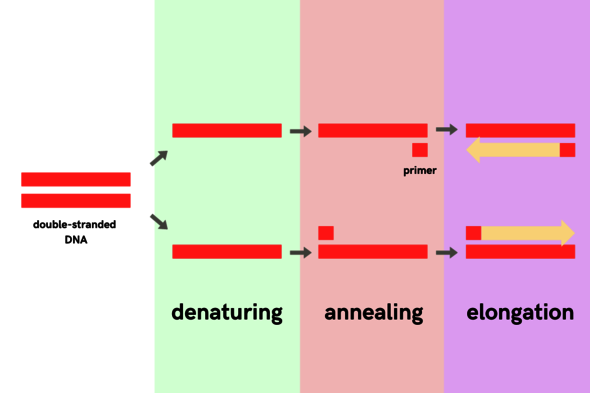
De drie stappen van PCR
Voorbereiding
PCR bestaat uit drie stappen: denaturatie, annealing en elongatie. Om hieraan te beginnen is een DNA-template nodig. Het genetisch materiaal van het coronavirus bestaat uit RNA. Dit lijkt op DNA, maar bestaat niet uit een dubbele streng maar een enkele. Bovendien heeft RNA net iets andere bouwblokken dan DNA. Door behandeling met het enzym ‘reverse transcriptase’ wordt het RNA omgezet naar DNA, hierna kan de PCR beginnen.
Stap 1: denaturatie
Het DNA-monster wordt verhit tot ongeveer 95 graden Celsius. Door de hoge temperaturen ‘smelten’ de twee gewikkelde strengen uit elkaar.
Stap 2: annealing
De primers, een soort vlaggetjes die het gezochte stukje DNA afbakenen, hebben nu de ruimte om aan het DNA te binden. In geval van een PCR-test voor corona, binden de primers aan een stukje genetisch materiaal wat specifiek is voor het coronavirus. Als dit niet aanwezig is (omdat iemand geen corona heeft) dan zullen de primers dus niet kunnen binden. Het monster koelt tijdens deze stap af naar zo’n 60 graden Celsius, omdat de primers bij die temperatuur het best werkzaam zijn.
Stap 3: elongatie
Het kopiëren kan beginnen. Het enzym verantwoordelijk voor het kopieerproces noemen we DNA polymerase, deze leest het gebied tussen de twee primers af en maakt hier een kopie van. Als de primers niet kunnen binden, omdat er geen coronavirus aanwezig is, dan zal er dus ook niks gekopieerd worden.
Een hele dag voor je uitslag
“Om voldoende DNA te hebben om dit uiteindelijk te kunnen meten, moet je 30 tot 40 keer zo’n reactie doen. Eén reactie duurt een paar minuten, wat betekent dat een complete PCR-reactie zo’n twee uur duurt,” vertelt Merkx.
Echter, tijdens de coronapandemie duurde het doorgaans een volledige dag voordat je je uitslag kon verwachten, soms wel twee. Naast de lengte van het testproces is volgens Merkx ook de benodigde PCR-apparatuur een bottleneck geweest. “Voor PCR heb je specifieke apparatuur nodig (voor de temperatuurwisselingen, red.), die vind je eigenlijk alleen in een medisch microbiologisch laboratorium en niet bij bijvoorbeeld de huisarts,” zegt hij. De noodzaak van specifieke apparatuur, gekwalificeerd personeel, en de reistijd van de afnamelocatie naar de laboratoria speelde dus ook een rol.
Dan was er natuurlijk nog de zelftest. Wederom een stokje in je neus, maar dan thuis aan je eigen eettafel. “Daarmee meet je de aanwezigheid van eiwitten van het virus, en niet het DNA of RNA,” vertelt Merkx. “Die zijn wel snel, en je kunt ze thuis doen, maar die zijn niet zo gevoelig.” Fijn om alvast een idee te krijgen dus, maar door de lage gevoeligheid geen vervanging van de PCR-test. “De essentie van onze nieuwe methode is dat deze net zo snel is als die zelftest, maar even gevoelig als een PCR-test,” aldus Merkx.
De essentie van onze nieuwe methode is dat deze net zo snel is als die zelftest, maar even gevoelig als een PCR-test
Je uitslag terwijl je wacht
De reden dat Merkx streeft naar zowel snelheid als gevoeligheid is niet zonder reden. Uiteindelijk hoopt hij zijn methode namelijk in te zetten bij huisartsen en andere zorgverleners. “Het grote voordeel is dan dat je in het tijdsbestek van je bezoek aan de huisarts direct een uitslag hebt. Zodat je meteen weet: oké ik moet wel of niet thuisblijven, of ik heb wel of geen medicatie nodig.” Om dit waar te maken moesten er twee alternatieven gevonden worden.
In de eerste plaats een alternatief voor PCR. Een methode om, zoals bij PCR, genetisch materiaal te vermenigvuldigen, maar dan sneller, makkelijker uit te voeren, en met minder complexe apparatuur.
In de tweede plaats moest er een alternatief komen voor fluorescentie. “Bij PCR heb je natuurlijk het kopieerproces, maar vervolgens ook een manier om DNA dat gekopieerd is te detecteren. Dat is vaak op basis van fluorescentie,” legt Harm van der Veer uit, promovendus in de onderzoeksgroep van Merkx. Fluorescentie zorgt ervoor dat het gekopieerde doel-DNA (bijv. van het coronavirus) oplicht wanneer het aanwezig is. Zo weten ze in het laboratorium: deze persoon is wel of niet besmet. “Daar heb je ook weer een apparaat voor nodig wat je niet typisch bij de huisarts hebt staan,” vult Van der Veer aan. Dus zochten ze naar een lichtgevend alternatief dat ook zonder uitgebreide apparatuur zou werken.
Het grote voordeel is dan dat je in het tijdsbestek van je bezoek aan de huisarts direct een uitslag hebt
RPA in plaats van PCR
Om het kopieerproces sneller en makkelijker te maken is er voor RPA (recombinase polymerase amplification) gekozen, een methode die net als PCR genetisch materiaal vermeerdert. “Anders dan bij PCR hoef je daar niet continu de temperatuur voor te veranderen. In plaats van het smelten, gebruiken we een enzym dat de twee delen van een DNA-streng als het ware uit elkaar duwt bij een lage temperatuur,” vertelt Van der Veer. “Het hele proces kan bij die ene lage temperatuur gebeuren.” Volgens Merkx en Van der Veer heeft het niet hoeven wisselen van temperatuur, wat nu bij PCR het geval is, belangrijke voordelen.
Ten eerste is de apparatuur minder complex en daardoor ook minder duur. Ten tweede duurt de kopieerstap slechts 10-15 minuten doordat er niet na elke stap gewisseld moet worden in temperatuur, en een nieuw gevormd DNA-molecuul meteen weer opnieuw gekopieerd kan worden. “Dus je krijgt een veel snellere exponentiële toename (van genetisch materiaal, red.),” legt Merkx uit. “Dat is van cruciaal belang als je snel een test moet doen.”
Bioluminescentie in plaats van fluorescentie
“Dit (RPA, red.) wordt al gebruikt, maar vaak zit je bij de uitleeskant net als bij PCR vast aan fluorescentie,” zegt Van der Veer. “Daar komt onze bioluminescentie uitleesmethode van pas.”
Bioluminescentie is het produceren van licht door organismen. Vooral bekend bij vuurvliegjes, maar ook verschillende bacteriën en vele diepzeebewoners zijn in staat zelf licht te genereren. “Zo’n 50 procent van de diepzeeorganismen kan licht produceren,” vertelt Merkx. Heel logisch eigenlijk, want diep in de zee is het pikkedonker.
Het grote voordeel van bioluminescentie ten opzichte van fluorescentie is dat het makkelijker zichtbaar is. Als het fel genoeg is dan is het met het blote oog al zichtbaar. Maar om het nauwkeuriger te analyseren is een digitale camera nodig - zoals tegenwoordig op iedere smartphone zit.
luciferine + O₂ + luciferase —> oxyluciferine + CO₂ + licht
Lichtgevende garnaal
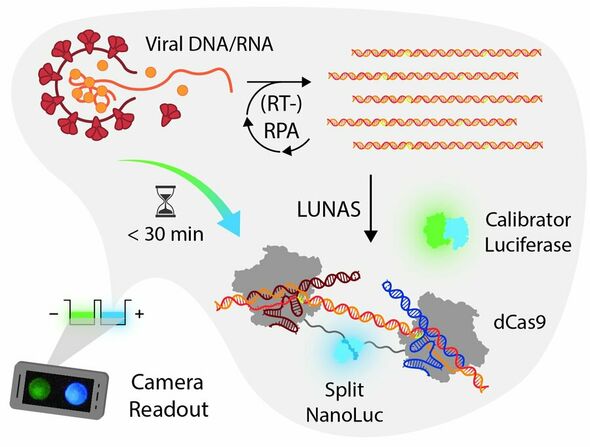
De bioluminescentie uitleesmethode van Merkx heet LUNAS (LUminescent Nucleic Acid Sensor) en maakt gebruikt van het lichtgevende enzym NanoLuc, afkomstig uit een garnaal die kilometers diep in de zee leeft (officiële naam: Oplophorus gracilirostris). Hiermee kan de garnaal zelf licht produceren. “Dit (licht, red.) gebruiken ze als afleidingsmanoeuvre,” legt Merkx uit. “Wanneer ze in gevaar zijn, omdat ze bijvoorbeeld bijna worden opgegeten door een ander dier.”
Maar hoe produceert de garnaal dit licht? “Die garnaal spuwt dan tegelijk zowel het enzym, het luciferase (NanoLuc, red.) uit, als het substraatmolecuul (ook wel luciferine, red.). Dat substraatmolecuul wordt door het enzym geoxideerd,” vertelt Van der Veer. “Daarbij ontstaat er een nieuw productmolecuul, maar ook een foton. En dat is wat licht geeft.”
Iedere bioluminescente soort heeft een specifieke luciferase, dit bepaalt onder andere de kleur van het geproduceerde licht. Bij de zeegarnaal in kwestie is dit blauw licht.
In de praktijk
Maar hoe werkt dit in de praktijk? De huisarts of een andere zorgverlener neemt jouw monster af. Met behulp van RPA wordt het DNA/RNA uit je monster gekopieerd totdat het voldoende is om gedetecteerd te worden.
Om ervoor te zorgen dat de blauwe lichtreactie alleen plaatsvindt wanneer het doel-DNA/RNA (bijvoorbeeld van het coronavirus) aanwezig is, is de blauwe luciferase uit de garnaal (NanoLuc) in twee delen gesplitst. Ieder deel is gekoppeld aan een eiwit dat het doel-DNA/RNA op kan sporen (het CRISPR-eiwit genaamd dCas9).
Wanneer het doel-DNA/RNA aanwezig is dan bindt het ene dCas9-eiwit (met het eerste NanoLuc-fragment) op een specifieke plaats, en het andere dCas9-eiwit (met het tweede NanoLuc-fragment) vlak ernaast. Zo worden de twee helften van NanoLuc bij elkaar gebracht zodat ze weer één geheel kunnen vormen waarna er blauw licht wordt geproduceerd. Wanneer het doel-DNA/RNA niet aanwezig is zullen de dCas9-eiwitten nergens aan kunnen binden, waardoor het luciferase gesplitst blijft en dus geen blauw licht kan produceren.
“De test produceert sowieso altijd groen licht,” vertelt Van der Veer. Dit gebeurt met een tweede luciferase, de kalibrator, en werkt als een controle. “Dit tweede luciferase hebben we gekoppeld aan een groen fluorescerend eiwit, waardoor er groen licht wordt geproduceerd,” legt Merkx uit. “Als het target-DNA aanwezig is dan verandert het van groen naar blauw licht en dan blijft het blauw. Om de uitslag te bepalen, of iemand wel of niet geïnfecteerd is, meten we de verhouding groen en blauw licht,” zegt Merkx.
Dit hele proces van RPA tot aan de verkleuring duurt ongeveer 15 minuten, en kan met simpele apparatuur worden uitgevoerd. “We hebben aangetoond dat je het met een digitale camera, die ook in je smartphone zit, goed uit kunt lezen.” Ideaal voor bij de huisarts dus.
Vervangt dit de PCR-test?
Ja en nee. “Onze methode is iets meer geschikt voor wel-niet,” zegt Van der Veer. “Maar dat is typisch de vraag bij infectieziekten, heb je het wel of heb je het niet?” Hij legt uit dat PCR, naast infectieziekten, ook wordt ingezet voor ander soort testen. Bijvoorbeeld wanneer je de concentratie van bepaald DNA/RNA wilt meten wat in lage concentraties normaal is, maar boven een specifieke grens kan duiden op kanker. “PCR kan nauwkeuriger de concentratie van de hoeveelheid RNA of DNA in een sample meten. Dus als dat je vraag is, dan is PCR beter.” Maar, vult hij aan “dat gaat dus meestal niet om de infectieziekten.”
Toekomstvisie
“We zijn deze test ook aan het ontwikkelen voor malaria,” vertelt Van der Veer. “Malaria komt vooral veel voor op het platteland in Afrikaanse landen, daar heb je niet de medische infrastructuur met laboratoria die wij hier hebben.” Daarnaast, vult hij aan, is het van groot belang dat medicijnen alleen worden genomen wanneer iemand daadwerkelijk malaria heeft. Het onnodig nemen van medicatie creëert namelijk resistentie voor deze medicatie in de populatie. “Dat betekent dat je snelle en goedkope diagnostiek nodig hebt bij iemand waarvan je vermoedt dat hij of zij malaria heeft, zodat je meteen weet of het echt malaria is,” vervolgt hij. “En daar is deze methode dus bij uitstek geschikt voor. Omdat het goedkoop, snel, en makkelijk is.”
Naast corona en malaria is de techniek van Merkx en Van der Veer in principe voor iedere infectieziekte in te zetten. Zo hopen zij, met een beetje hulp van Oplophorus gracilirostris, jou zo snel mogelijk van je uitslag te voorzien.



Discussie