Sluitstuk | Medicijn in een virus
Mensen die lijden aan een ernstige stofwisselingsziekte moeten nu vaak tientallen keren per jaar naar het ziekenhuis voor een peperduur infuus. Om die behandeling efficiënter te maken, zou het medicijn toegediend kunnen worden in de eiwitmantel van een virus. Promovendus Daan Vervoort sleutelde aan het omhulsel van virusdeeltjes om dat mogelijk te maken.
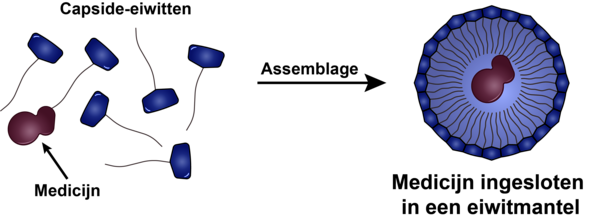
Na een dik jaar coronapandemie doet het woord ‘virus’ bij veel lezers wellicht de rillingen over de rug lopen, maar Daan Vervoort benadrukt dat deze vervelende ziekteverwekkers ook heel nuttig kunnen zijn. Dat is in ieder geval de insteek van het promotieproject van de biomedisch ingenieur. “De gedachte is dat je medicijnen veel efficiënter op de juiste plek in het lichaam kunt krijgen door ze op te sluiten in het lege omhulsel van virusdeeltjes.”
Die methode kan van grote waarde zijn voor mensen die lijden aan zogeheten lysosomale stapelingsziektes. Bij die erfelijke aandoeningen, waaronder de ziektes van Fabry, Gaucher en Pompe, hopen afvalstoffen zich op in het lichaam omdat de patiënt te weinig enzymen -‘moleculaire schaartjes’ - aanmaakt om deze stoffen af te breken. Afhankelijk van welk enzym ontbreekt, ontstaan daardoor allerlei ernstige klachten.
Infuus
De meest toegepaste behandeling van stapelingsziektes bestaat uit het toedienen van de ontbrekende enzymen, legt Vervoort uit. “Daarvoor moet de patiënt bijvoorbeeld om de twee weken naar het ziekenhuis voor een infuus, wat al ingrijpend is. Het overgrote deel van het medicijn komt bovendien helemaal niet in de juiste lichaamscellen terecht, maar wordt al in de bloedbaan afgebroken.”
De therapie is daardoor niet zo effectief als je zou willen, terwijl het produceren van de enzymen een kostbare zaak is. Zo’n levenslange behandeling kost per patiënt nu jaarlijks rond de twee ton, aldus de promovendus. “Ons voornaamste doel is een effectievere therapie te ontwikkelen voor de patiënten, maar als je de medicatie heel gericht kunt toedienen in virusdeeltjes, heb je ook maar een kleinere hoeveelheid enzymen nodig. De kostenbesparing die dat oplevert, zou deze therapie wereldwijd een stuk toegankelijker maken.”
Lees verder onder de illustratie
Virussen hebben in de loop van miljoenen jaren ‘geleerd’ hoe ze tot in de cellen van hun gastheren kunnen doordringen om deze nieuwe virusdeeltjes te laten maken. Een belangrijk deel van dit evolutionaire succes hangt samen met de eiwitmantel van het virus, die niet alleen het virale erfelijke materiaal beschermt, maar er ook voor zorgt dat het virusdeeltje zich kan hechten aan de juiste gastheercellen. Dat maakt een dergelijk omhulsel een ideale kandidaat om heel gericht medicinale enzymen af te leveren.
In de onderzoeksgroep Bio-Organic Chemistry werken ze daarom aan omhulsels gebaseerd op de eiwitmantel van een virus dat voorkomt in bonenplanten. “Het grote voordeel van deze specifieke eiwitmantel is dat deze zich spontaan vormt als je de bouwstenen, een zestigtal identieke eiwitten per mantel, onder de juiste omstandigheden bijeen brengt.” Dat biedt de mogelijkheid om medicinale enzymen in dergelijke eiwitomhulsels op te sluiten, simpelweg door de enzymen en de bouwstenen met elkaar te mengen en vervolgens de temperatuur, zuurgraad of zoutgehalte van deze oplossing te manipuleren.
Bloed
Helaas vielen de oorspronkelijke eiwitmantels van het bonenvirus juist uit elkaar bij een neutrale zuurgraad en een temperatuur van 37 graden, zoals in ons bloed. Om de omhulsels geschikt te maken voor het toedienen van medicijnen, moest dus de chemische structuur van de bouwstenen iets worden aangepast. “In onze groep zijn we erin geslaagd om bouwstenen te maken die bij vier graden Celsius niet assembleren tot capsiden, zoals we die omhulsels noemen. Dat is gunstig, omdat bij die temperatuur zowel de enzymen als de capside-eiwitten goed bewaard blijven. Vervolgens kunnen we om de medicinale enzymen heen eiwitmantels vormen die onder fysiologische omstandigheden stabiel zijn. Om dat voor elkaar te krijgen, hebben we specifiek percentage capside-eiwitten ‘vastgezet’ aan de enzymen.”
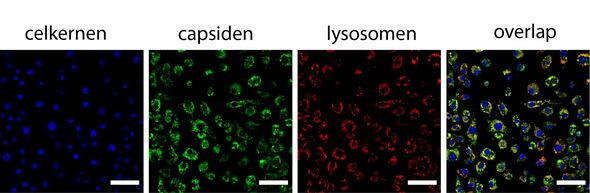
De volgende stap was te laten zien dat de medicijnpakketjes daadwerkelijk opgenomen door lichaamscellen. Door de omhulsels te voorzien van een lichtgevend molecuul, kon Vervoort onder een fluorescentiemicroscoop zien dat de capsides inderdaad terechtkomen op de juiste plek in de cel - namelijk in de lysosomen, waar de afvalverwerking plaatsvindt. “Ook heb ik kunnen aantonen dat de enzymen binnen de capside intact waren gebleven”, vertelt hij.
Lees verder onder de afbeelding
De onderzoekers willen nu kijken of de medicijnafgifte ook werkt in de cellen die door de stapelingsziekten zijn aangetast. “Daarvoor gaan we samenwerken met de Universiteit Leiden, die hiervoor speciaal patiëntcellen in kweek hebben.” De weg naar een daadwerkelijk medicijn is overigens nog lang, benadrukt Vervoort. “Als het in de celkweek blijkt te werken, moeten we eerst nagaan of er bij de productie van de omhulsels geen gifstoffen zijn ontstaan voordat we aan een dierstudie kunnen denken. Pas daarna zouden de eerste patiëntenstudies in zicht komen.”
Zelf zet hij zijn werk na zijn promotie in ieder geval als postdoc voort bij Bio-Organic Chemistry. “Ik wil gaan onderzoeken of ook andere eiwit-omhulsels dan virusdeeltjes potentieel geschikt zijn om medicatie tegen lysosomale stapelingsziekten af te leveren.”


Discussie