Varkenshart of hybride hart, waar moeten we onze tijd in steken?
Postdoctoraal onderzoeker Marijn Peters over de toekomst van harttransplantaties
In Nederland - maar ook wereldwijd - is een sterk donortekort. Vooral donorharten zijn erg schaars. Om de wachtlijsten terug te dringen wordt er intensief onderzoek gedaan naar alternatieven zoals het varkenshart en het hybride hart. Cursor sprak hierover met Marijn Peters, postdoctoraal onderzoeker in de onderzoeksgroep ‘Soft Tissue Engineering and Mechanobiology’ van de TU/e en bij het Regenerative Medicine Center van het Wilhelmina Kinderziekenhuis in Utrecht.
Afgelopen oktober is een Amerikaanse man, die een aangepast varkenshart kreeg, zes weken na de operatie alsnog gestorven. De 58-jarige man, Lawrence Faucette, was de tweede persoon ooit die zo’n genetisch gemodificeerd varkenshart als donororgaan ontving. De eerste patiënt, de 57-jarige David Bennett, overleed acht weken na de transplantatie.
Is er nog hoop voor het varkenshart?
“Een belangrijke kanttekening bij deze patiënten is dat ze terminaal waren. Dit soort studies doen ze alleen als een patiënt totaal geen perspectief op leven meer heeft”, zegt Peters. “De periode die iemand overleeft met zo’n orgaan wordt wel steeds langer. De laatste persoon leefde er bijna zes weken mee, en is uiteindelijk overleden aan iets dat wellicht voorkomen had kunnen worden. Er is daarom nog hoop dat het in de toekomst wel kan gaan werken.”
Beide patiënten die een varkenshart ontvingen zijn uiteindelijk overleden als gevolg van een varkensvirus, het porcine cytomegalovirus. Een variant van het cytomegalovirus komt ook bij mensen voor en is doorgaans onschuldig. Peters denkt dan ook niet dat het virus an sich het probleem is geweest, maar vooral het feit dat deze werd onderdrukt in het varken en dat dit niet gebeurde in de menselijke ontvanger. Incombinatie met de zware immuunsuppressie, de medicatie die iemand krijgt na het ontvangen van een donororgaan, heeft dit waarschijnlijk voor problemen gezorgd.
Immuunsuppressie zorgt ervoor dat het immuunsysteem van de ontvanger, ook wel de acceptor, onderdrukt wordt om afstoting van het lichaamsvreemde donororgaan te voorkomen. “Het is heel moeilijk om ooit honderd procent te garanderen dat een donororgaan helemaal geen pathogenen (ziekteverwekkers, red.) meer heeft”, geeft Peters aan. “Het probleem met zware immuunsuppressie, zoals het nu gebeurt, is dat wanneer er dan een virus aanwezig is je daar snel aan kan overlijden. Ook als dit helemaal geen ernstig virus is.”
Ze benadrukt dat zelfs wanneer een donororgaan volledig virusvrij is, een onderdrukt immuunsysteem nog steeds risico’s met zich meebrengt. “De patiënt kan natuurlijk ook een virus van buitenaf krijgen, zoals het griep- of coronavirus. Als het immuunsysteem van de acceptor dan zo erg onderdrukt is, wordt het heel moeilijk voor het lichaam om dit virus af te weren. Ieder mens heeft gewoon een goed functionerend immuunsysteem nodig.”
Los van de risico’s, speelt immuunsuppressie een belangrijke rol bij de integratie van het nieuwe donororgaan in het lichaam van de acceptor en is het op dit moment een essentieel onderdeel van het transplantatieproces, stelt Peters. Volgens haar is er daarom een nieuwe balans nodig rondom immuunsuppressie. “Je wilt het menselijke immuunsysteem (van de acceptor, red.) zo laten functioneren dat het geen afstoting veroorzaakt, maar dat het wel zijn werk blijft doen. Die balans is op dit moment niet altijd goed.”
Een virus als oplossing
Om deze balans te creëren doet Peters onderzoek naar de mogelijkheid om de sterke immuunreactie na transplantatie te verkleinen of zelfs weg te nemen, om zo de kans op afstoting te verkleinen. Indien succesvol toegepast zou, als bijkomstigheid, mogelijk minder immuunsuppressie nodig zijn.
Om bovenstaande voor elkaar te krijgen worden virussen gebruikt. Dat klinkt misschien paradoxaal,maar Peters legt uit waarom juist virussen hiervoor geschikt zijn. “Virussen zijn erg efficiënt. Ze zijn heel goed beschermd tegen het immuunsysteem van de gastheer zodat ze niet opgemerkt worden”, vertelt ze. “Op het moment dat we gebruik kunnen maken van deze eigenschap om donororganen lichaamseigen te laten lijken, dan hebben patiënten misschien wel veel minder immuunsuppressie nodig.”
Om dit voor elkaar te krijgen wordt er gebruik gemaakt van een specifiek virusonderdeel. Het US2-eiwit, verantwoordelijk voor het ‘ontduiken’ van het immuunsysteem. “Dit eiwit voorkomt dat er een soort vlaggetjes aan de buitenkant van de donorcellen komen, die het immuunsysteem normaal gesproken gebruikt om lichaamsvreemde cellen te herkennen”, legt Peters uit. “Als deze vlaggetjes niet, of in mindere mate, aan de buitenkant van de cellen komen dan kan het immuunsysteem de donorcellen dus niet herkennen, en is de kans kleiner dat ze worden afgestoten.” Het officiële jargon voor deze vlaggetjes is humaan leukocytenantigenen, ofwel HLA’s.
Het inbrengen van het US2-eiwit gebeurt door middel van transductie. Het gen voor het eiwit wordt verpakt in een zogenaamd transportvirus dat zich niet meer kan delen. Dit virus is dus niet schadelijk, maar bezit nog wel de vaardigheid om een menselijke cel binnen te dringen. Eenmaal in de cel kan het gen afgeschreven worden om zo het US2-eiwit te produceren en zijn werk te laten doen om de ‘vlaggetjes’ te voorkomen.
Bovenstaand onderzoek voert de TU/e uit in samenwerking met Leiden Universitair Medisch Centrum (LUMC). LUMC heeft het principe al aangetoond bij de transplantatie van menselijke alvleeskliercellen in muizen. “Zij hebben al laten zien dat het kan met cellen”, stelt Peters. “En nu zijn wij (bij de TU/e, red.) dat systeem aan het bekijken bij volledige weefsels en organen, middels de transplantatie van humane hartkleppen.”
Het hybride hart
Deze techniek zou niet alleen de kans op succes kunnen vergroten bij de transplantatie van varkensharten, maar ook bij andere alternatieven zoals het hybride hart. Een hybride hart zou, net als donorharten afkomstig van mensen of varkens, getransplanteerd kunnen worden als donororgaan om de volledige hartfunctie over te nemen.
Eerdere systemen waren nooit in staat dit te doen. Neem bijvoorbeeld het zogenaamde steunhart, of wel de Left Ventricular Assist Device (LVAD). Een systeem dat wordt aangesloten op het eigen hart van de patiënt. Een LVAD neemt - zoals de naam al aangeeft - niet de volledige functie van het hart over, maar ondersteunt enkel de linkerventrikel; de hartkamer die zuurstofrijk bloed naar de rest van het lichaam pompt. Omdat een LVAD niet de volledige hartfunctie overneemt kan het slechts gebruikt worden als tussenmedium voor patiënten die bijvoorbeeld wachten op een donorhart.
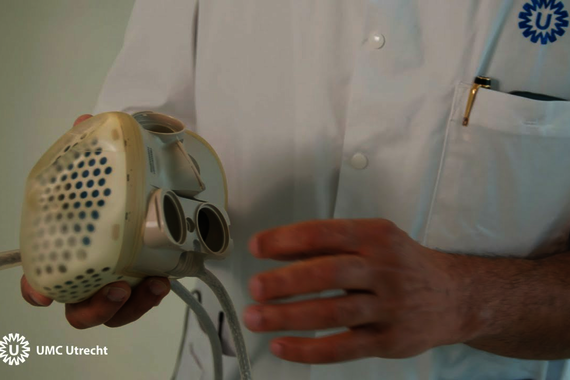
Een LVAD kan dus ondersteunen en tijdrekken, maar het biedt geen langetermijnoplossing. Zo ontstond de vraag naar een kunsthart dat wel gebruikt zou kunnen worden als volwaardig donororgaan. Vaak wordt hier ook wel de term ‘hybride hart’ voor gebruikt. De meeste kunstharten bevatten namelijk ook biologisch materiaal en zijn dus deels mechanisch en deels biologisch. “Het is een mechanisch systeem, een kunsthart, dat op een bepaalde manier wordt vermenselijkt”, vult Peters aan.
In 2021 ontving de eerste Nederlander een hybride hart. Dit hybride hart bestond uit een kunststof buitenkant gemaakt van polyurethaan en een binnenkant bekleed met biologisch materiaal afkomstig uit het hartzakje van een rund. Middels een kabel via de buikwand werd het hybride hart aangesloten op een controller en een set batterijen. Via een schoudertas kon de patiënt de controller, van ongeveer drie kilo, met zich mee dragen. De patiënt was een 54-jarige man die vanwege zijn ernstige hartfalen en slechte gezondheid niet meer in aanmerking kwam voor een regulier (menselijk) donorhart. Hij heeft nog ruim acht maanden met zijn hybride hart geleefd voordat hij in juni 2022 kwam te overlijden.
Bovenstaande versie van het hybride hart is slechts één voorbeeld. Er bestaan verschillende alternatieven en varianten onder de verzamelnaam ‘hybride hart’, en deze lijst zal naar alle waarschijnlijkheid blijven groeien.
In Eindhoven wordt gewerkt aan een hybride hart met specifiek menselijk weefsel. Dit zou de kans op afstoting verkleinen, en daarmee de kans op overleving vergroten. Het Hybrid Heart Consortium, waar de onderzoeksgroep ‘Soft Tissue Biomechanics and Tissue Engineering’ (STBE) van de TU/e deel van uitmaakt, doet hier onderzoek naar.
Er bestaan verschillende manieren om een kunsthart te vermenselijken. Zo kan een kunsthart bekleed worden met menselijk donorweefsel, maar nog veiliger is om het kunsthart te bekleden met patiënteigen weefsel. “De groep van Patricia Dankers werkt nu aan een soort hydrogel”, vertelt Peters. “De binnenkant van het hybride hart wordt hiermee bekleed. Wanneer het hart wordt getransplanteerd in de acceptor vormt deze gel een laag waar circulerende patiënteigen cellen aan kunnen hechten.”
Peters legt uit dat deze techniek gebaseerd is op de principes die we bij wondgenezing zien. “Wanneer je een wond oploopt dan worden er allerlei schadeprocessen geactiveerd waarbij er nieuw weefsel ontstaat. Het idee is dat je dat mechanisme van het opnieuw bekleden van een wond ook kan gebruiken bij zo’n hart”, vertelt ze. “Zo kun je dus een soort half kunstmatig, half patiënteigen hart maken.”
Waar moeten we onze tijd in steken?
Naast traditionele harttransplantaties, van mens op mens, wordt er op dit moment dus vooral gewerkt aan twee hoofdalternatieven om het donortekort tegen te gaan. Xenotransplantatie, ofwel transplantatie van een orgaan dat niet menselijk is zoals een varkenshart, en meer mechanische systemen die worden vermenselijkt, zoals het hybride hart. Maar waar moeten de wetenschap zijn tijd in steken? “Het probleem is dat we in het hele onderzoeksveld proberen zo min mogelijk dieren te gebruiken”, stelt Peters. “En als je dan een heel systeem ontwikkelt waarbij varkens dienen als donordepot voor mensen, dan is dat een groot ethisch vraagstuk.”
Varkens waarvan het hart als donororgaan kan dienen worden hier namelijk specifiek voor gefokt en genetisch gemodificeerd. Zo worden er een aantal menselijke genen toegevoegd en een paar varkensgenen uitgeschakeld. Ook worden de varkens periodiek gescreend op allerhande pathogenen.
De betrokken onderzoeksgroepen van de TU/e hebben hun focus daarom op het tweede alternatief gericht: het hybride hart. “Waarom zouden we al onze tijd en middelen stoppen in een orgaandepot maken bij dieren?” vraagt Peters zich hardop af. “Terwijl we inmiddels zo goed zijn in tissue engineering. We zijn al heel ver met het hybride hart dat het misschien net zo goed doet.” Ondanks dat de focus op alternatieven ligt die dichterbij de mens blijven, levert het onderzoek hier in Eindhoven wellicht ook waardevolle kennis voor de toekomst van xenotransplantatie.


Discussie