Sluitstuk | Het bot beter begrijpen
In het menselijk bot wordt weefsel continu afgebroken en aangemaakt door twee soorten cellen: osteoclasten en osteoblasten. Stefan Remmers, promovendus bij de faculteit van Biomedical Engineering, heeft uit menselijke cellen een 3D-model van osteoblasten en osteoclasten opgekweekt dat het mogelijk maakt om zowel botaanmaak als -afbraak gedurende de tijd te visualiseren en te kwantificeren. Het 3D-model kan in de toekomst helpen bij de ontwikkeling van nieuwe behandelingen van botziektes zoals osteoporose. Remmers zal dinsdag 14 maart zijn proefschrift verdedigen.
Ogenschijnlijk is het menselijk bot een statisch orgaan dat eenmaal volgroeid niet veel meer verandert, maar het tegenovergestelde is waar. Oud en beschadigd weefsel wordt continu afgebroken en vervangen door nieuw botweefsel. Twee soorten botcellen zijn betrokken bij deze processen: osteoclasten zijn verantwoordelijk voor de botafbraak en osteoblasten voor de aanmaak van nieuw weefsel. Bij gezonde volwassenen is er een evenwicht tussen deze twee processen, maar wanneer dit verstoord raakt, kan dit leiden tot degeneratieve ziektes.
Osteoporose
Bij osteoporose zijn de osteoclasten actiever dan de osteoblasten, waardoor er meer bot wordt afgebroken dan aangemaakt. De botmassa neemt hierdoor af en de botdichtheid is uiteindelijk zo laag dat de botten fragiel worden en makkelijk breken. In Nederland lijden er zo’n 800.000 mensen - voornamelijk postmenopauzale vrouwen – aan osteoporose. “We kunnen de aftakeling van de botsterkte met medicatie remmen, maar we kunnen het proces niet meer terugdraaien. Als je eenmaal osteoporose hebt, dan kom je er nooit meer vanaf”, vertelt Remmers. “Helaas weten we niet genoeg over het bot om dit soort ziektes te kunnen genezen.”
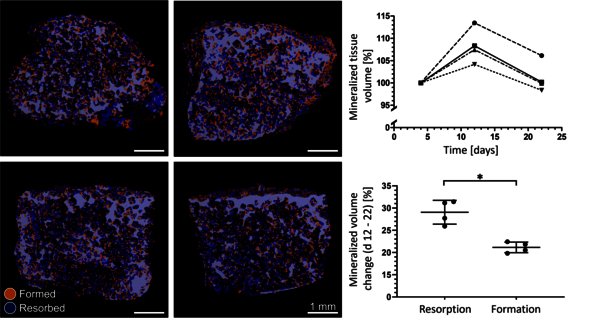
Om de complexe processen van botaanmaak en -afbraak beter te kunnen bestuderen, heeft Remmers tijdens zijn promotietraject een 3D-model van osteoblasten en osteoclasten ontwikkeld. “Een soort van minibotjes van vijf bij drie millimeter, opgekweekt in het lab uit menselijke cellen”, legt hij uit. Het 3D-model bevat beide soorten humane cellen en bootst hiermee zowel de botaanmaak als botafbraak buiten het menselijk lichaam na. Het bijzondere aan dit model is dat deze processen gedurende de tijd gekwantificeerd en gevisualiseerd kunnen worden. “Eigenlijk wist ik van tevoren niet of het überhaupt kon”, geeft de promovendus toe. Remmers’ model van osteoblasten en osteoclasten biedt meer inzicht in de complexe processen waarbij deze cellen betrokken zijn. In de toekomst zou het model kunnen helpen bij de ontwikkeling van nieuwe behandelingen van botziektes zoals osteoporose.
De onvoorspelbare osteoclasten
“Osteoblasten zijn redelijk makkelijke cellen om mee te werken”, vertelt Remmers. “Maar de osteoclasten begrijpen we nog niet helemaal.” Osteoclasten zijn aparte cellen omdat ze niet op de normale manier differentiëren vanuit stamcellen, maar ontstaan door celfusie; daarbij komen meerdere cellen samen en worden samen één. “Soms zijn het er tien en soms zijn het er vijftien en we weten niet waarom”, aldus Remmers. Dit maakt de cellen onvoorspelbaar.
Remmers ging uit van een bestaand 3D-model met osteoblasten, maar de grote uitdaging was om osteoclasten aan dit model toe te voegen. Deze moesten bovendien functioneel genoeg zijn zodat de functionaliteit meetbaar zou zijn met een CT-scan. “Een celkweekmodel opzetten is al niet makkelijk, maar bij twee soorten cellen is het helemaal lastig”, legt de promovendus uit.
Remmers besefte al snel dat enkel experimenteren in het lab onbegonnen werk was. Daarom ging hij op zoek naar alle co-culture studies - experimenten met osteoblasten en osteoclasten - die ooit zijn gepubliceerd om alle data te verzamelen die hem verder zouden kunnen helpen. Uiteindelijk is hij een heel jaar fulltime bezig geweest om bijna vierduizend papers te screenen, te analyseren en om alle relevante gegevens te verwerken in een aantal databases. Hiermee heeft hij een handig naslagwerk gecreëerd voor iedereen die in de toekomst hetzelfde gaat bestuderen, maar het heeft hem vooral in staat gesteld om veel gerichter experimenten uit te voeren. In de databases kon hij filteren op verschillende criteria en zo kon hij snel zien wat er op basis van eerdere studies wel werkt en wat niet.
Het celkweekproces is langzaam en vergt veel geduld. Je hebt weken tot maanden nodig om osteoblasten uit de stamcellen te kweken voordat je er osteoclasten aan kunt gaan toevoegen. Deze worden opgekweekt uit monocyten, een specifiek type witte bloedcellen. Daarna gaan er weer weken overheen voordat er resultaat te zien is. Het gewenste resultaat was in dit geval dat de osteoclasten het botweefsel zouden afbreken en de osteoblasten nieuw weefsel zouden aanmaken – precies zoals het in het menselijk bot gebeurt.
Deze veranderingen zijn niet te zien met het blote oog. Remmers maakte eerst CT-scans van zijn opgekweekte botjes in verschillende stadia, legde deze over elkaar en liet een software uitrekenen welke voxels (3D-pixels) anders waren dan eerst. “Ik wist precies hoe het eruit zou zien als het werkte, maar de vraag was óf het zou lukken.” De spanning was natuurlijk groot en de opluchting enorm toen er na maanden secuur werk in het lab op de computer precies de juiste resultaten te zien waren – de osteoblasten en osteoclasten waren beide actief in het model en deden precies wat ze moesten doen: het bot aanmaken en afbreken, respectievelijk.
Gepersonaliseerde behandeling
Remmers’ model is een proof of concept, oftewel de eerste realisatie van een nieuw model. Het is nu duidelijk dat het mogelijk is om in het lab een 3D-model van osteoblasten en osteoclasten op te kweken, maar het model is nog niet direct toepasbaar. Als het model verder doorontwikkeld wordt, dan kan het gebruikt worden om allerlei soorten onderzoek naar osteoblasten en osteoclasten te verrichten, wat ons in staat stelt om het bot beter te begrijpen.
In de toekomst zou een doorontwikkeld model gebruikt kunnen worden om medicatie op te testen. Hiermee zou je dierproeven, die voor humane medicatie op dit moment verplicht zijn, niet helemaal kunnen vervangen, maar het zou als tussenstap in het proces kunnen dienen om het aantal dierproeven te verminderen.
Remmers’ favoriete toepassing, maar telkens eentje die nog de meeste doorontwikkeling nodig heeft om ooit gerealiseerd te worden, is gepersonaliseerde behandeling van patiënten. “Stel dat je het 3D-model uit de cellen van de patiënt zou kunnen opkweken. Dan zou je in het lab precies kunnen zien hoe de cellen van de patiënt op een bepaalde medicatie reageren. Zo zou je patiënten met osteoporose veel gerichter kunnen behandelen met medicatie waarvan je weet dat deze aanslaat.”


Discussie